2024年7月30日,中國國家藥品監督管理局藥品審評中心(CDE)同意香雪生命科學的TAEST16001注射液納入突破性治療品種名單,標志著該產品作為中國第一個IND獲批開展臨床試驗的TCR-T細胞治療新藥取得重大突破。
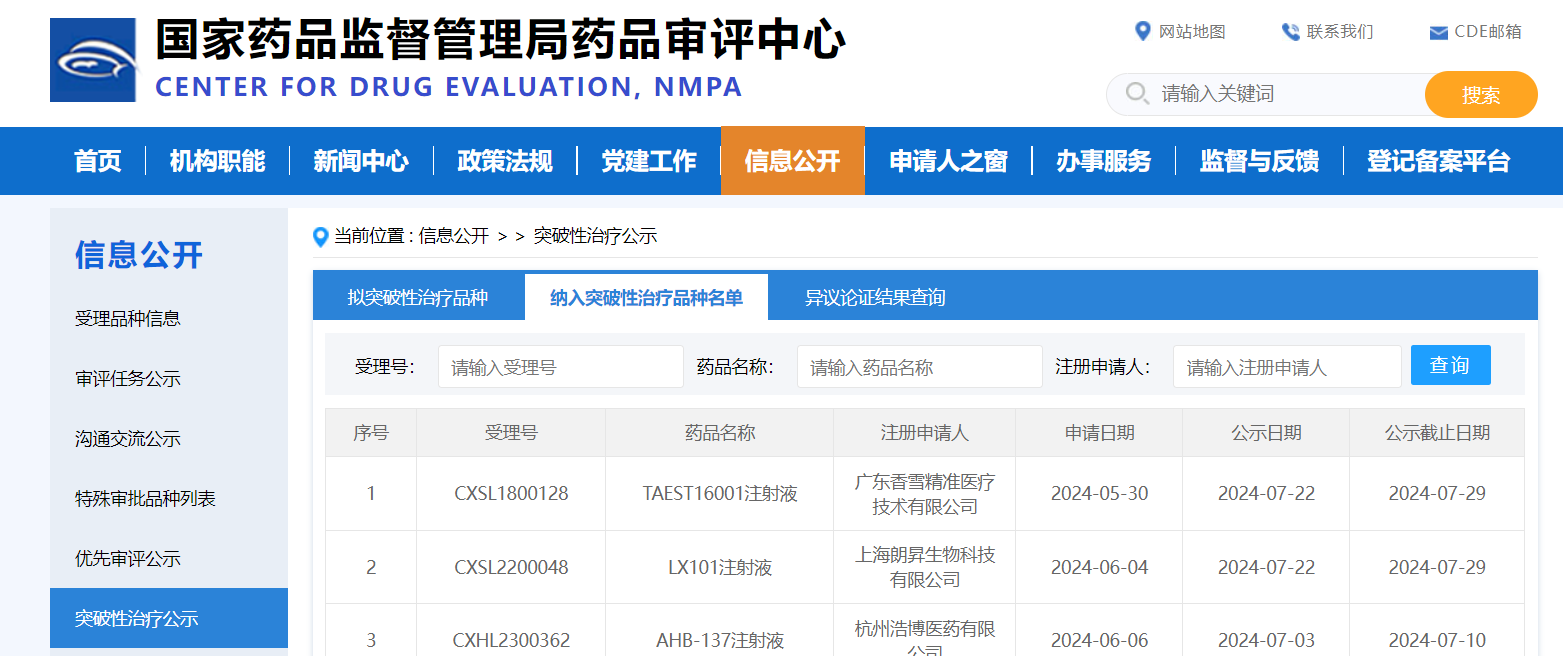
TAEST16001注射液是基于香雪生命科學TCR-T細胞產品技術開發平臺和生產制備體系開發的第一個TCR-T細胞治療產品,其原理是將病人的T細胞在體外用基因工程改造,把帶有NY-ESO-1腫瘤抗原特異性的TCR基因的慢病毒轉染T細胞后體外擴增,再把TCR-T細胞回輸給病人,達到治療腫瘤的目的。TAEST16001以廣州中山大學腫瘤防治中心和北京大學腫瘤醫院作為牽頭單位開展臨床試驗,目前已完成I期臨床試驗和II期臨床試驗第一階段的研究工作。
隨著全球腫瘤發病率的不斷上升,腫瘤治療市場的需求日益增大,僅免疫細胞治療市場空間,預計就將由2021年的13億元增長至2030年的584億元,年均增速高達53%。而TCR-T療法作為前沿的細胞免疫治療方法,市場前景尤為廣闊。
“我們從2012年開始投入TCR-T項目,十年磨一劍,現在終于獲得了一定的成果。”香雪制藥董事長王永輝表示,作為國內TCR-T細胞治療的頭部企業,香雪生命科學計劃依托廣州在大灣區的核心區位優勢,拉動產業集群效應,與國家醫學中心和臨床機構協同發展,建設全球最大的TCR-T細胞產品區域制備生產平臺,“扎根于廣州的香雪生命科學,會堅持技術創新和研發投入,為廣州乃至粵港澳大灣區的生物醫藥產業持續產生價值和創造效益。”
編輯:張順鵬
更多精彩資訊請在應用市場下載“央廣網”客戶端。歡迎提供新聞線索,24小時報料熱線400-800-0088;消費者也可通過央廣網“啄木鳥消費者投訴平臺”線上投訴。版權聲明:本文章版權歸屬央廣網所有,未經授權不得轉載。轉載請聯系:cnrbanquan@cnr.cn,不尊重原創的行為我們將追究責任。
 長按二維碼
長按二維碼關注精彩內容






